スルホニルウレア系除草剤(SU剤)抵抗性を迅速に検定する方法は海外の畑雑草で提唱されており1),この方法ではSU剤の作用点であるアセト乳酸合成酵素 (acetolactatesynthase:ALS)のin vivo assay法を利用することにより,SU剤抵抗性を視覚的に判断することが出来る。筆者らはこの方法に改良を加えて,アゼトウガラシ属水田雑草やイヌホタルイ,コナギについて2~3日間で迅速検定が可能な方法を確立している4,5)。以下,この迅速検定法の原理や実際の操作,注意点などについて記す。
検定法の原理
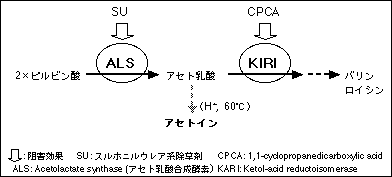
ALSは分岐鎖アミノ酸合成経路の酵素であり,ALS阻害型除草剤であるSU剤はこの酵素を阻害する(図-1)。ALSの活性によって合成されるアセト乳酸は,図1に示したような分岐鎖アミノ酸合成経路の中でケトール酸リダクイソメラーゼ(ketol-acid reductoisomerase: KARI)によって更に代謝されるため,KARIの阻害剤を処理するとアセト乳酸が代謝されず組織内に蓄積する。この蓄積量はALS活性に依存するため,蓄積量を定量すればALS活性を測定できる。KARI阻害剤を処理した植物組織と,KARI阻害剤に加えてSU剤を処理した植物組織との間でアセト乳酸の蓄積量を比較すれば,ALS活性がSU剤によって阻害されているかどうかが分かる。すなわち,SU剤を処理して蓄積が阻害されれば,ALS活性が阻害されていると判断し,SU剤感受性と判定できる。SU剤を処理してもアセト乳酸が蓄積する場合は,ALS活性が阻害を受けていないと判断し,SU剤抵抗性と判定できる。アセト乳酸はアセトインに変換後,比色分析によって赤色に発色するため,その蓄積量は視覚的に容易に判定できる。
この方法で重要なのは,SU剤処理をしない場合に強い赤色の発色が得られる系を作ることである。SU剤処理をしない場合の赤色の発色が不明瞭であれば,SU剤による阻害効果の有無を判定することはできない。従って,除草剤無処理の場合に安定して高いALS活性が検出できるよう,下記に記すように検定試料や処理条件などに注意することが重要となる。
実際の操作・注意点
実際の手順は,(1)対象雑草から葉などを採取して試薬処理を行う(表1),(2)処理試料からアセト乳酸を抽出して比色分析する(表2),という手順となる。結果は,比色分析による赤色の発色程度によって診断する。以下に各段階での操作と注意点を記す。
(1)試薬処理:
処理溶液を調製して試験管に分注し,雑草の葉(花茎)を切り取って入れ,約2日間,明条件で静置する(表1)。この静置の間に,ALS活性に依存して試料内にアセト乳酸が蓄積する。
実際には一つのサンプルに対して2本の試験管を用意し,片方だけにSU 剤を加える。両方に加える処理溶液の組成は25%ムラシゲスクーグ培地用混合塩類,500μMCPCA(KARIの阻害剤),10mMピルビン酸ナトリウム(ALSの基質)とする。この処理溶液は冷凍保存が可能であるため,あらかじめ調整して小分けしたものを冷凍保存しておけば毎回調整する手間が省ける。検定に使用するSU剤には,SU剤の単剤として市販されているチフェンスルフロンメチル水和剤(商品名: ハーモニー)を使用する。チフェンスルフロンメチル水和剤の濃度を100ng/mlとなるように調製すると感受性ではアセトインの蓄積による発色がほとんど見られず,抵抗性との差異が明確に区別できる。アゼトウガラシ属水田雑草のうちのアメリカアゼナ,タケトアゼナ,アゼトウガラシ,およびイヌホタルイでは,上記の除草剤濃度が適当であることを確認しているが,アゼナでは感受性個体にごくまれに薄い発色が見られることがある。アゼナの検定で薄い発色が見られた場合には他の方法による確認を要する。
原著では溶液の葉への浸透性を高めるために界面活性剤(0.025% Triton X-100)を処理溶液に加えている1)が,水田雑草の場合は原著の濃度で界面活性剤を加えると葉の周辺部が白化して損傷がみられる場合がある。水田雑草の場合は界面活性剤を加えなくても検定に問題は無く,加える場合でも1/10程度の濃度で十分である。
検定試料としては,どの草種でも生育が旺盛な個体の生育が旺盛な部位を使用する必要がある。アゼトウガラシ属水田雑草では展開中の葉2-4枚を含む茎頂部をまるごと切り取って使用する。イヌホタルイでは伸長中の花茎の小穂着生部位近辺(5cm程度)を1-3本使用する。イヌホタルイを処理溶液に浸す際には,浸透性を良くするために花茎を2-5mm程度の長さに細断してから浸す必要がある。コナギでは展開した葉でほとんど発色が見られないため,株元に隠れている未展開葉を1-2枚使用する。開花期のコナギでは未展開葉を採取するのが難しくなるため,開花期前のコナギを試料とする。
処理溶液に浸した後は2日間ほど明条件で静置する。ALS活性が高い場合は1日でも十分な活性を検出できるが,2日間の静置によってより明瞭な結果が得られる。処理が終わった試料は冷凍して保存する。一旦冷凍する事によりアセト乳酸の抽出効率が良くなるため,処理後すぐにアセト乳酸を抽出する場合でも一旦冷凍した方がよい。
表1 試薬処理の手順
|
(1) |
1サンプルにつき2本の15ml試験管を用意し、4mlの処理溶液*を入れる。 |
|
↓ |
|
|
(2) |
2本の試験管の片方に除草剤**を加える。 |
|
↓ |
|
|
(3) |
各試験管に30~60mgの検定試料を入れ***、30℃明条件で2日間(40-55時間程度)静置する。 |
|
↓ |
|
|
(4) |
試験管から試料を取り出し,冷凍保存する。 |
*処理溶液
25% ムラシゲ・スクーグ培地用混合塩類
500μM 1,1-cyclopropanedicarboxylic acid
10mM ピルビン酸ナトリウム
**試験管内で100ng/mlとなるように,10mg/Lに調整した75%チフェンスルフロンメチル水和剤(商品名ハーモニー)を40μL加える。
***アゼトウガラシ属水田雑草では成長点を含む茎頂部及び幼葉2~4枚、イヌホタルイでは花茎上部約5cmを1~3本、コナギでは未展開葉1~2枚を試料とする。イヌホタルイは花茎を3~5mmに切断する。検定試料は生育の旺盛な個体から採取し、採取後直ちに試薬処理を行う。
表2 アセト乳酸の抽出と比色分析
|
(1) |
1.5mlチューブに300μlの蒸留水を入れて凍結保存試料を浸し、60℃で5分間静置する。 |
|
↓ |
|
|
(2) |
常温で45分間静置する。 |
|
↓ |
|
|
(3) |
試料が入らないように100μlとり、新たな1.5mlチューブに移す。 |
|
↓ |
|
|
(4) |
10μlの5%(v/v)H2SO4を加え、60℃で30分間静置する。 |
|
↓ |
|
|
(5) |
50μlの0.5%(w/v)クレアチン溶液と50μlの5%(w/v)1-ナフトール溶液*を加える。 |
|
↓ |
|
|
(6) |
37℃で30分間静置し、赤色の発色により抵抗性を検定する**。 |
*1-ナフトールは2.5N NaOH溶液に溶かして5%(w/v)溶液とする。また,使用直前に調製する。
**除草剤無処理試料で赤色の発色がない場合は再検定が必要。除草剤処理試料で赤色の発色があれば抵抗性、無ければ感受性と判定。
(2)アセト乳酸の抽出と比色分析:
原著では乳棒と乳鉢を用いて葉を磨砕している1)が,試料中のアセト乳酸は蒸留水に浸して撹拌するだけでも抽出される(表-2)。
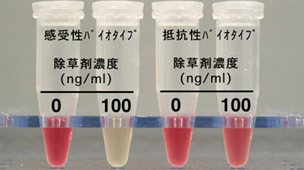
抽出液に硫酸を加えて60℃に30分間静置することで,アセトインの脱炭酸が進みアセトインができる。その後,クレアチンと1-ナフトールを加えることにより,アセトインが赤色に発色する。1-ナフトール溶液は,2.5NのNaOH溶液に溶かして5%(v/v)溶液とし,毎回使用直前に調製する。アセトインの発色は,時間とともに濃くなり約30~40分で最大となる。アセトインの定量は530nmの吸光度の測定によって可能であるが,検定では特にアセトインを定量しなくとも,赤色の発色で視覚的に診断できる。すなわち,除草剤処理をした検定について赤色の発色があれば抵抗性,なければ感受性と診断される(写真1)。
引用文献
1)Gerwick, B. C., L. C. Mireles and R. J. Eilers. 1993. Weed Technol. 7, 519-524.
2)Hamamura,K., T. Muraoka, J. Hashimoto, A. Tsuruya, H, Takahashi, T. Takeshita and K. Noritake. 2003. Weed Biology and Management 3: 242-246.
3)大野修二・柳沢克忠・花井涼・村岡哲郎 2004. 雑草研究 49: 277-283.
4)内野彰 2002. 雑草研究 47, 197-201.
5)内野彰・渡邊寛明 2003. 雑草研究 48(別), 30-31.
6)汪光煕 2001. 日本雑草学会編「雑草科学実験法」,pp362-363.